Asam sinamat memiliki rumus kimia C6H5CHCHCOOH atau C9H8O2, yang juga memiliki sinonim dari asam trans-3-fenil-propenoat sebagai nama IUPAC dan nama trivial nya yaitu asam trans-β-fenilakrilat. Asam sinamat ini berwujud kristal putih, sedikit berbau balsam dan rasanya pedas. Kelarutan asam sinamat yaitu sedikit larut dalam air, tetapi kelarutannya dalam air dapat meningkat ketika menggunakan air panas, mudah larut dalam alkohol, etanol, larut dalam kloroform, sangat mudah larut dalam benzena, eter, asam asetat glasial, aseton, karbon disulfida, dan minyak. Asam sinamat juga mempunyai titik leleh 133°C serta titik didih 300°C. Asam sinamat termasuk dalam senyawa fenol yang dihasilkan dari lintasan asam sikimat dan reaksi berikutnya. Kegunaan asam sinamat ialah sebagai bahan baku kimia, misalnya sebagai bahan baku untuk mensintesis asam hidrosinamat melalui reaksi reduksi, sebagai bahan baku pembuatan ester metil, etil, benzil melalui reaksi esterifikasi, sebagai herbisida dan pestisida, juga dapat digunakan sebagai antibakteri, antijamur, analgesik, antiinflamasi, choleretic, pencahar dan pencegah kanker. Selain dibuat secara sintesis, sebenarnya asam sinamat ini juga teresterifikasi di alam dalam bentuk bebas yaitu di dalam akar Rheum palmatum, Balsam Peru, Benzoin Sumatra, Balsam Tolu, Minyak kayu manis, dan juga ada yang berada di Daun Koka.
Asam sinamat disintesis dalam bentuk trans karena lebih stabil. Sedangkan isomernya yang berbentuk cis, mempunyai nama asam allosinamat yang mempunyai sifat tidak stabil dan dapat berubah menjadi bentuk trans.
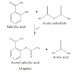
Senyawa-senyawa turunan sinamat dapat juga disintesis dengan reaksi
Perkin, yaitu kondensasi aldol antara aldehida aromatik yang sesuai dan
anhidrida asam karboksilat, dengan adanya garam natrium dari asam tersebut
sebagai katalis. Pada reaksi ini, kondensasi terjadi antara gugus karbonil dari
aldehida dan gugus menaktif dari anhidrida asam. Sedangkan fungsi dari
katalis ialah untuk membentuk anion dan gugus metil aktif tersebut.

Turunan sinamat dapat pula disintesis menggunakan reaksi
knoevenagel, yaitu kondensasi aldol antara suatu aromatik aldehid yang sesuai
dengan asam atau ester malonat, dengan adanya katalis basa. Cara lain untuk
mensintesis senyawa-senyawa turunan sinamat aldehida aromatik yang sesuai
dengan ester asetat, yaitu dengan adanya katalis basa. Sintesis asam sinamat
didasarkan pada kondensasi Knoevenagel dari dietilmalonat dengan benzaldehida
yang dikatalisis oleh oksida campuran Mg/Al, Mg–Al + Ln (Ln = Dy, Gd), atau Li/Al
seperti yang ditunjukkan pada Gambar dibawah ini.

Mekanisme reaksinya terjadi seperti gambar
dibawah ini.

PERMASALAHAN
- Terdapat pada blog saya bahwa, kelarutan asam sinamat itu sedikit larut dalam air, tetapi mudah larut dalam alkohol ataupun etanol. Mengapa hal itu bisa terjadi dan apa yang menyebabkannya? (Vika Seputri)
- Reaksi kondensasi Knoevenagel lebih sering digunakan dalam sintesis asam sinamat dibandingkan dengan reaksi perkin. Mengapa hal itu demikian? (Wafiqah Alvia)
- Pada sintesis asam sinamat di kerapkali di gunakan katalis dietilamina yang merupakan amina sekunder. Bagaimana jika katalis yang di gunakan jenis amina primer apakah yang akan terjadi? (Nurkhalishah)
- Pada blog saya terdapat 2 metode reaksi untuk mensintesis asam sinamat yaitu reaksi perkin dan reaksi knoevenagel. Pada suatu keadaan ketika sintesis sinamat dari bahan awal benzaldehida dengan senyawa pengadisi asam malonat dengan katalis basa piridina dan pipeeidina (knoevenegal) dan dengan senyawa pengadisi anhidrida asetat dan katalis basa kalium asetat (perkin). Manakah yang memiliki hasil reaksi yang lebih banyak diantara 2 keadaan tersebut? (Wisliana)
- Apa yang terjadi jika sintesis asam sinamat dilakukan berdasarkan reaksi kondensasi knoevenagel antara benzaldehida dan asam malonat dengan katalis dietilamina? (Mashita)
- Disebutkan dalam blog saya bahwa, ketika dalam pembuatan asam sinamat ketika semakin kuat basa yang digunakan maka pembentukan asam sinamat diyakini akan semakin cepat dan hasil produk lebih banyak. Apa yang menyebablan hal tersebut dapat terjadi, apa pengaruh dari si basa yang digunakan itu? (Bella Veronica)

Jadi kami telah diskusi mengenai artikel tentang sintesis
langsung asam sinamat dari asam karboksilat alifatik dan aldehida aromatik
dengan adanya boron tribromida, dan hasilnya adalah disini kami membahas
mekanisme dari gambar reaksi diatas yaitu: pertama, asam karboksilat alifatik 1
bereaksi dengan boron tribromida dan menghasilkan (A) perantara yang stabil,
triasil borat, yang berperan sbgai kimiawi anhidrida campuran. Nah Borat ini,
dengan adanya 4-DMAP, menghasilkan zat antara (B) reaktif yang bereaksi dengan
aldehida aromatik (2) dengan mekanisme yang diketahui, menghasilkan asam
sinamat (3). Adanya 4-DMAP sebagai katalis, menghasilkan zat antara (B) reaktif
yang bereaksi dengan aldehida aromatik (2) dengan mekanisme yang diketahui,
menghasilkan asam sinamat (3). Kehadiran 4-DMAP dan piridin diperlukan untuk
pembentukan produk.
Kemudian kami juga membahas bahwa dengan adanya boron tribromida,
reaksi antara aromatik aldehida dan asam karboksilat alifatik untuk mendapatkan
asam sinamat dimungkinkan pada kondisi, melalui sintesis langsung baru.
Pendekatan baru ini memungkinkan persiapan berbagai asam sinamat dalam hasil
baik hingga tinggi (hingga 81%). Berbeda dengan metode klasik (cf. Reaksi
Perkin, dll.), Alternatif kami menggunakan karboksilat alifatik asam, bukan
anhidrida yang sesuai.