Pada pertemuan kali ini kita akan membahas tentang "Kontrol Kinetika dan Kontrol Termodinamika dalam Sintesis Senyawa Organik". Dimana kita telah mengetahui bahwa Kinetika adalah suatu ilmu yang membahas tentang laju (kecepatan) dan mekanisme reaksi. Berdasarkan penelitian yang mula-mula dilakukan oleh Wilhelmy terhadap kecepatan inversi sukrosa, ternyata kecepatan reaksi berbanding lurus dengan konsentrasi / tekanan zat–zat yang bereaksi. Laju reaksi dinyatakan sebagai perubahan konsentrasi atau tekanan dari produk atau reaktan terhadap waktu.
Berdasarkan jumlah molekul yang bereaksi, reaksi terdiri atas :
1. Reaksi unimolekular : hanya 1 mol reaktan yang bereaksi
Contoh : N2O5 –> N2O4 + ½ O2
2. Reaksi bimolekular : ada 2 mol reaktan yang bereaksi
Contoh : 2HI –> H2 + I2
3. Reaksi termolekular : ada 3 mol reaktan yang bereaksi
Contoh : 2NO + O2 –> 2NO2
Setelah kita mengetahui apa itu kinetika, sekarang kita membahas apa itu termodinamika. Termodinamika (dalam bahasa Yunani: thermos = ‘panas’ and dynamic = ‘perubahan’) yaitu fisika energi, panas, kerja, entropi dan kespontanan proses. Termodinamika sangat berhubungan dengan mekanika statistik di mana terdapat banyak hubungan termodinamika berasal. Pada sistem dimana terjadi nya proses perubahan wujud atau pertukaran energi, termodinamika klasik tidak berhubungan dengan kinetika reaksi (kecepatan suatu proses reaksi berlangsung). Karena alasan ini lah, penggunaan istilah “termodinamika” biasanya menjurus pada termodinamika setimbang. Dengan hubungan ini dapat kita ketahui, konsep utama dalam termodinamika adalah proses kuasistatik, yang diidealkan, proses “super pelan”. Proses termodinamika ini bergantung-waktu dipelajari dalam termodinamika tak-setimbang.
Nah selanjutnya kita akan membahas tentang kontrol termodinamika dan kontrol kinetika. Kontrol termodinamika atau kinetika dalam reaksi kimia itu dapat menentukan komposisi campuran produk reaksi ketika jalur bersaing mengarah pada produk yang berbeda serta selektivitas dari pengaruh kondisi reaksi tersebut.Kondisi reaksi seperti suhu, tekanan atau pelarut mempengaruhi jalur reaksi, maka dari itu kontrol termodinamika maupun kinetika adalah satu kesatuan dalam dalam suatu reaksi kimia. Kedua kontrol reaksi ini disebut juga sebagai faktor termodinamika dan faktor kinetika, dengan uraian sebagai berikut:
1.
Faktor Termodinamika
(adanya stabilitas realtif dari produk)
Pada suhu tinggi, reaksi berada di bawah
kendali termodinamika (ekuilibrium, kondisi reversibel) dan produk utama berada
dalam sistem lebih stabil.
2.
Faktor Kinetika (kecepatan
pembentukan produk)
Pada temperatur rendah, reaksi ini di bawah kontrol kinetika (tingkat, kondisi irreversible) dan produk utama adalah produk yang dihasilkan dari reaksi tercepat.
Berikut Konsep kontrol termodinamika yaitu :
Jika suhu rendah maka konsentrasi banyak molekul terbentuk banyak dan jika
suhu tinggi maka konsentrasi sedikit molekul yang dihasilkan sedikit.
Berikut Konsep kontrol kinetika yaitu :
Jika suhu besar maka tekanan harus besar juga agar mencapai kestabilan dan jika suhu rendah maka tekanan kecil.
Selanjutnya ke topik senyawa organiknya, apabila kita ingin membuat senyawa organik yang berkualitas dan banyak maka kita dapat memakai konsep kontrol termodinamika dan konsep kontrol kinetika. Agar produk yang dihasilkan sesuai dengan yang kita inginkan dan mendapat produk yang banyak dan dengan tingkat kestabilan besar.
Pengertian Kinetika dan Termodinamika Enolat
Senyawa karbonil yang memiliki H alfa jika digunakan pada kondisi asam, maka akan membentuk enol, sedangkan pada kondisi basa akan membentuk ion enolat. Kondisi asam 3 termasuk kontrol termodinamika karena mengacu pada kestabilan intermediet (enol). Sedangkan pada kondisi basa, termasuk kontrol kinetika karena mengacu pada terbentuknya ion enolat yang berjalan cepat. Perlakuan metil keton dengan LDA biasanya menghasilkan hanya lithium enolat pada sisi metil. Enolat ini akan terbentuk cepat, dan berikutnya dikenal dengan nama enolat kinetik. Beriku alasan mengapa terbentuk cepat:
1. Proton pada gugus
metil yaitu lebih asam.
2. Terdapat 3 H alfa
pada sisi metil dibandingkan 2 H alfa pada sisi lainnya.
3. Terdapat hambatan
sterik pada penyerangan LDA pada sisi lain dari gugus karbonil.
Mekanisme enolat
Dalam reaksi kondensasi apabila digunakan katalis basa moderat seperti ion hidroksida atau alkoksida, maka reaksi aldol terjadi melalui serangan nukleofil oleh stabilitas resonansi ion enolat pada gugus karbonil. Produk aldol yaitu garam alkoksida, kemudian terbentuklah aldol itu sendiri. Setelah itu akan mengalami dehidrasi membentuk senyawa karbonil tidak jenuh. Mekanisme selengkapnya dapat dilihat pada gambar 5.
Tahap 1. Mekanisme aldol terkatalis basa

Tahap 2. Dehidrasi

Gambar 5.
Mekanisme Enolat

Produk termodinamika dan kinetika
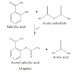
Pada contoh reaksi diatas kontrol kinetika dapat dilakukan dengan menggunakan LDA pada suhu -78°C. Hal ini akan memberikan perbandingan kinetika dengan termodinamika sebesar 99 : 1. Sedangkan kontrol termodinamika dapat dilakukan dengan trifenil metil litium pada suhu kamar, yang akan memberikan selektivitas 10 : 90.
Gambar 6. Produk termodinamika dan kinetika

Diagram Kontrol kinetik dan Termodinamik
Pada diagram diatas dapat dijelaskan
bahwa bahan awal (SM) dapat bereaksi untuk memberikan dua produk yang berbeda
yaitu P1 (garis hijau) dan P2 (garis biru) melalui jalur yang berbeda. Pada reaksi
1 (hijau) menghasilkan P1, dimana reaksi pada P1 akan bereaksi lebih cepat
karena memiliki keadaan transisi lebih stabil (TS1). Hal ini dikarena adanya
penghalang aktivasi yang lebih rendah. Jadi P1 adalah produk kinetika.
Pada reaksi 2 (biru) menghasilkan P2. P2 adalah produk yang lebih stabil karena
berada pada energi yang lebih rendah dari P1. Jadi P2 adalah produk
termodinamika.
Secara umum, kinetika dari enolat dengan cara reaksi dilakukan pada kondisi dingin. Hal ini akan terjadi ikatan ionik antar logam-oksigen dan deprotonasi berlangsung cepat dalam kondisi yang lebih ringan. Sedangkan pada termodinamika dari enolat terjadi pada temperatur yang lebih tinggi dan terjadi ikatan kovalen logam-oksigen. Waktu kesetimbangan nya lebih longgar pada deprotonasi dengan sejumlah sub-stoikiometrik dari basa kuat. Penggunaan sejumlah sub-stoikiometrik basa memungkinkan dihasilkan nya sejumlah kecil fraksi senyawa karbonil tak-terenolasi untuk menyeimbangkan enolat ke regioisomer termodinamika dengan bertindak sebagai sumber proton.
Jadi, dapat kita simpulkan bahwa enolat kinetika adalah enolat yang terbentuk pada sisi keton yang kurang tersubstitusi. Sedangkan pada enolat termodinamika yaitu enolat yang terbentuk pada sisi keton yang lebih tersubstitusi. Hal tersebut dapat dijelaskan yaitu sama seperti alkena, yaitu pada suatu enol atau enolat akan lebih stabil pada posisi yang lebih tersubstitusi. Contoh yang paling sukses dari enol silil termodinamika adalah 1-fenilpropan-2-on.
PERMASALAHAN
- Pada konsep kontrol termodinamika, mengapa pada konsentrasi yang banyak digunakan suhu yang rendah? (Vika Seputri)
- Sebagaimana contoh yang telah saya paparkan di atas, dinyatakan bahwa pada kontrol termodinamika produk yang terbentuk ialah B dengan suhu tinggi, apakah produk B ini tidak akan terbentuk jika suhu yang di gunakan ialah suhu rendah? (Dewi Mariana Elisabeth)
- Mengapa suhu dijadikan sebagai kunci utama atau faktor utama dalam kestabilan relatif dan kecepatan relatif dalam mengontrol sintesis senyawa kimia organik supaya produk yang diperoleh lebih stabil dan banyak ? (Bella Veronica Simanjuntak)
- Dikatakan bahwasanya, kondisi reaksi seperti suhu, tekanan, pelarut akan mempengaruhi jalur reaksi mana yang lebih disukai, yakni terkendali secara kinetik maupun termodinamika. Dan kondisi tersebut hanya berlaku jika adanya energi aktivasi dari dua jalur yang berbeda. Nah, mengapa energi aktivasi menjadi faktor penting untuk mengetahui jalur mana yang lebih disukai yakni antara kontrol kinetika maupun termodinamika? (Khusnul Khotimah)
- Hal apa yang harus diperhatikan atau dilakukan dalam kontrol kinetika dan kontrol termodinamika untuk didapatnya produk hasil reaksi yang stabil? (Jony Erwin Situmorang)
- Kondisi reaksi seperti suhu, tekanan atau pelarut mempengaruhi jalur reaksi. Pada temperatur tinggi, reaksi dibawah kontrol termodinamika. Sedangkan pada temperatur rendah, reaksi di bawah kontrol kinetika. Jika reaksi berada pada temperatur ruang, apakah kontrol termodinamika atau kinetika yang mengendalikan reaksi tersebut? Jelaskan! (Kelantan)
- Mengapa energi bebas produk dalam suatu reaksi harus lebih kecil dari pada energi reaktan yang menghasilkan ∆G negatif? (Andrika Dwi Sakti)



Tidak ada komentar:
Posting Komentar