Karbon merupakan salah satu dari beberapa elemen yang dapat membentuk rantai panjang atom sendiri, yang disebut dengan katenasi. Hal ini ditambah dengan kekuatan ikatan karbon-karbon yang menimbulkan sejumlah besar bentuk molekul, banyak yang merupakan elemen struktural yang penting dari kehidupan, sehingga senyawa karbon itu memiliki bidang mereka sendiri yaitu studi "kimia organik".
Ikatan karbon-karbon adalah suatu ikatan kovalen antara dua atom karbon. Bentuk yang paling umum yaitu ikatan tunggal. Ikatan tunggal adalah ikatan yang tersusun atas dua elektron, satu dari masing-masing dua atom. Ikatan tunggal karbon-karbon adalah suatu ikatan sigma dan dikatakan terbentuk dari satu orbital hibrid dari masing-masing atom karbon. Dalam etana, orbital sp3 yaitu orbital hibrid, tetapi ikatan tunggal terbentuk antara atom karbon dengan hibridisasi lain memang terjadi (misalnya sp2 ke sp2). Bahkan, pada atom karbon dalam ikatan tunggal tidak perlu dari hibridisasi yang sama.
Atom karbon itu memiliki massa 12 dengan nomor
atom 12. Konfigurasi elektronnya yaitu 1s2, 2s2, 3p2 dan mengalami hibridisasi dimana 1 elektron dari orbital 2s
berpindah ke orbital 2pz, sehingga memiliki konfigurasi yang stabil 1s2, 2s1, 2p3, dengan membentuk
orbital hybrid sp3. Sehingga atom
karbon juga memiliki kesempatan untuk membentuk empat ikatan dengan atom
lainnya, kestabilan struktur karbon ini ditunjukan dengan sudut yang sama
109,50 dengan bentuk tetrahedral.

Berdasarkan
karakteristik tetrahedral maka atom karbon itu dapat mengikat atom lainnya
selain atom karbon itu sendiri. Secara sederhana, atom karbon dapat membentuk
empat ikatan dengan atom hidrogen. Kerangka senyawa hidrokarbon dibangun oleh
banyaknya ikatan antar atom karbonnya. Kerangka senyawa hidrokarbon yang paling
sederhana yaitu memiliki sebuah atom karbon, dilanjutkan dengan dua atom
karbon, tiga atom karbon dan seterusnya
Dalam berikatan sesama atom karbon terdapat tiga kemungkinan, yaitu yang pertama membentuk ikatan tunggal, yang kedua ikatan rangkap dua dan yang terakhir ikatan rangkap tiga. Untuk penyederhanaan dapat kita ibaratkan seperti ikatan tunggal terjadi dari orbital s dan disebut ikatan sigma pada orbital hibrid sp3 dan bentuk molekul tetrahedron dengan sudut 109,50. Senyawa dengan ikatan tunggal disebut dengan senyawa hidrokarbon jenuh.
Adapun panjang ikatan tunggal C–C adalah 0,154 nm.
Percabangan juga sering terjadi pada C-C kerangka. Atom karbon yang berbeda dapat diidentifikasikan sehubungan dengan jumlah karbon tetangga:
1.
Atom karbon primer: satu atom karbon tetangga
2.
Atom karbon sekunder: dua atom karbon tetangga
3.
Atom karbon tersier: tiga atom karbon tetangga
4. Atom karbon kuartener: empat atom karbon tetangga

Sintesis
Reaksi ikatan pembentukan
karbon-karbon merupakan reaksi organik di mana ikatan karbon-karbon baru
terbentuk. Mereka sangat penting dalam produksi bahan kimia buatan manusia seperti
obat-obatan dan plastik.
Pembentukan
Ikatan C-C
1 . Melalui
reaksi radikal bebas

Tidak
terkendali, dan juga dapat melakukan reaksi berantai (tidak digunakan dalam
sintesis).
2 . Melalui reaksi antara C+ dengan C-

Lebih
terkendali (digunakan dalam sintesis).
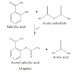
Contoh reaksi
lain yang membentuk ikatan karbon-karbon adalah reaksi Aldol, reaksi
Diels-Alder, penambahan reagen Grignard ke grup karbonil, reaksi Heck, reaksi
Michael dan reaksi Wittig.
Telah menemukan bahwa I2 / Ph3P / imidazole yang baik untuk
konversi alkohol menjadi iodida adalah selektif primer, jadi 1 diubah dengan
lancar menjadi 2.

Konversi alkohol menjadi azida juga baik dilakukan,
kombinasi reagen baru yang ringan untuk mempengaruhi transformasi ini. Iodida
adalah komponen dari campuran reaksi, sehingga penggantian alkohol benzilik
sekunder dilanjutkan dengan rasemisasi parsial. Hasil stereokimia dengan
alkohol sekunder terisolasi tidak dilaporkan.

Baik hidrogenasi (Rosenmund) dan hidrida telah digunakan
untuk mereduksi asam klorida menjadi aldehida. Gugus nitro dan alkena stabil
pada kondisi tersebut.

PERMASALAHAN
- Mengapa dalam melakukan sintesis terdapat pembatasan kurang dari 8 karbon? (Bella)
- Pembentukan ikatan C-C bisa melalui reaksi radikal bebas dan reaksi antara C nukleofil dan elektrofil, dan beberapa reaksi lainnya seperti reaksi aldol, grignard, claisen, dll. Contoh reaksi nya bisa dilihat pada blog saya. Nah mengapa ikatan tunggal C-C memiliki energi lebih besar dibandingkan dengan ikatan C=C (rangkap dua) ataupun ikatan C≡C (rangkap tiga)? (Vika)
- Pada transformasi gugus hidroksil, apabila hidroksi terikat dari suatu senyawa aromatik (fenol) reaksi biasanya hanya akan terjadi secara terbatas atau dengan kata lain terjadi pada posisi aromatiknya atau reaksi terjadi pada gugus OH-nya. Apabila pada aromatik maka biasanya reaksi substitusi elektrofilik. mengapa bisa demikian ? (Erma johar)
- Dari gambar berikut ini yang bisa dilihat dari blog saya. Dapat terlihat pada gambar tersebut bahwasannya perbandingan yang dimiliki pada reaksi itu sebesar 85 : 15 jelas terlihat bahwa bagian kiri memiliki nilai yang lebih besar dari pada yang kanan, nah mengapa hal itu bisa terjadi. (Halimah)
- Reaksi grignard termasuk salah satu reaksi pembentukan ikatan karbon. Mengapa organolitium nukleofil lebih kuat daripada gridnard yang sebanding ? (Susi)
- Dalam Organotembaga, dijelaskan bahwa organotembaga (RCu atau R2CuLi berfungsi sebagai nukleofilik yang selektif terhadap gugus pergi yang baik. Salah satu contohnya ialah reaksi (suatu gambar). Bagaimana penjelasan dari reaksi dari gambar tersebut? (Siti)





Tidak ada komentar:
Posting Komentar